La primera Ley de la Termodinámica nos ha permitido entender que la energía puede interconvertirse de una forma en otra, pero no puede crearse o destruirse. En otras palabras, que la energía se puede transferir entre el sistema y sus alrededores o se puede convertir en otra forma de energía, pero la energía total permanece constante.
La primera ley nos ayuda a hacer el balance, por así decirlo, respecto al calor liberado o absorbido, al trabajo efectuado o recibido, en un proceso o reacción en particular, pero, no podemos emplear este argumento para saber si un proceso sucede o no.
La primera ley nos ayuda a hacer el balance, por así decirlo, respecto al calor liberado o absorbido, al trabajo efectuado o recibido, en un proceso o reacción en particular, pero, no podemos emplear este argumento para saber si un proceso sucede o no.
La segunda Ley de la termodinámica nos explica por qué los procesos químicos suceden de manera espontánea.
Si analizamos el proceso de fusión del agua, que es endotérmico a presión atmosférica
H2O(s) → H2O(l)
H2O(s) → H2O(l)
- Cuando T > 0°C, el hielo fundirá espontáneamente, pero a esa misma temperatura y presión, la conversión de agua líquida en hielo será no espontánea.
- Cuando T < 0°C se cumple lo contrario, el agua líquida se convierte en hielo espontáneamente, y la conversión del hielo en agua no es espontánea.
¿Qué sucede a T = 0°C, el punto de fusión normal del hielo?
Recuerda que en el punto de fusión normal de una sustancia, la fase sólida y la líquida se encuentran en equilibrio:
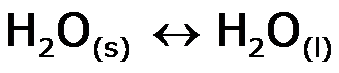
• Lo que significa que se están interconvirtiendo con la misma rapidez.
• El proceso de pasar de sólido a líquido ó de líquido a sólido se produce con la misma preferencia.
• Nos lleva a la conclusión que el proceso no se favorece espontáneamente en un sentido o en el otro.
Recuerda que en el punto de fusión normal de una sustancia, la fase sólida y la líquida se encuentran en equilibrio:
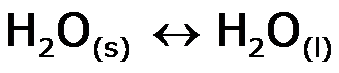
• Lo que significa que se están interconvirtiendo con la misma rapidez.
• El proceso de pasar de sólido a líquido ó de líquido a sólido se produce con la misma preferencia.
• Nos lleva a la conclusión que el proceso no se favorece espontáneamente en un sentido o en el otro.
Siguiendo con el analisis y teniendo en cuenta que el calor (q) y trabajo (w) no son funciones de estado, ambos dependerán de caminos específicos para llegar de un estado a otro.
Si nos imaginamos que:
Fundimos 1 mol de H2O(s) a 0 °C y 1 atm, para formar un mol de H2O(l) a 0 °C y 1 atm
Fundimos 1 mol de H2O(s) a 0 °C y 1 atm, para formar un mol de H2O(l) a 0 °C y 1 atm
- Para conseguir este cambio debemos agregar cierta cantidad de calor,
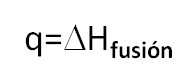
- Si deseamos, volver el sistema a su estado original, simplemente invertimos el procedimiento, es decir quitamos la misma cantidad de calor que agregamos originalmente. Ya que la fusión y congelación del agua a 0°C son proceso reversibles.
- Sin embargo, fundir un mol de hielo, colocándolo en un laboratorio a temperatura ambiente es un proceso irreversible, no podemos seguir el mismo camino de regreso al estado original. La única manera sería reducir la temperatura del agua a 0 °C, para formar de nuevo hielo.
Entropía:
Un proceso tendrá una marcada tendencia a ser espontáneo, si al ocurrir, se favorece el desorden del sistema.
La definición de ENTROPÍA (S), será pues el grado de desorden o aleatoriedad* de un sistema.
La definición de ENTROPÍA (S), será pues el grado de desorden o aleatoriedad* de un sistema.
*al azar, sin orden establecido
Por lo tanto a medida que aumenta el grado de desorden del sistema, mayor será su entropía, por el contrario cuanto más alto sea el orden de un sistema, menor será el valor de la entropía del mismo.
Ssólido<Slíquido<Sgaseoso
Al igual que la energía y la entalpía, la entropía es una función de estado, por lo tanto:
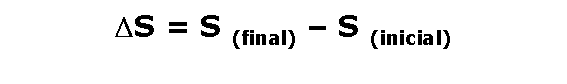
Si la variación de entropía es mayor a cero, esto significará que:

ha aumentado el grado de desorden del sistema, por lo tanto el proceso es: factible, espontáneo. En buena cuenta el proceso sucede.
Por el contrario, si el proceso nos conduce a una disminución del desorden o de la aleatoriedad, entonces la varicación de la entropía será menor a cero

Lo que implicará que el proceso no suceda, no se dé espontánemante.
La conexión entre la ENTROPÍA y la espontaneidad de una reacción queda expresada por la Segunda Ley de la Termodinámica:
La entropía del universo aumenta en un proceso espontáneo y se mantiene constante en un proceso en equilibrio.
La entropía del universo aumenta en un proceso espontáneo y se mantiene constante en un proceso en equilibrio.
Si el universo está constituido por el sistema más el entorno ó alrededores, para cualquier proceso, el cambio de entropía del universo,

será la suma del cambio de entropía del sistema, más el cambio de entropía del entorno o alrededores. La expresión matemática para la Segunda Ley de la Termodinámica será la siguiente:


No hay comentarios:
Publicar un comentario